Benutzeranforderungen (URS) für Reinräume
Benutzeranforderungen (User Requirements Specification, Abkürzung URS) für Reinräume – Erstellen Sie das passende Lastenheft. Hier finden Sie...
Sie fragen sich, was Validierung, Qualifizierung oder Mapping bedeuten und wie sie in einer GxP-Umgebung angewendet werden? Hier finden Sie die Antworten!
Haben Sie sich jemals gefragt, was Validierung, Qualifizierung oder Temperatur-Mapping bedeutet und wie sie in einer GxP-regulierten Umgebung angewendet werden? Dieser Artikel beantwortet diese Fragen und erklärt, wie jeder Prozess die Einhaltung gesetzlicher Vorschriften, die Produktqualität und die Patientensicherheit unterstützt. Ausserdem erfahren Sie, weshalb ein risikobasierter Ansatz für die GxP-Validierung und die Einhaltung der Good Manufacturing Practice (GMP), Good Laboratory Practice (GLP) und Good Clinical Practice (GCP) unerlässlich ist.
Es gibt viele GxP-Richtlinien für gute Geschäftspraktiken. Und selbst wenn sich die Leitlinien widersprechen, sind sich alle Quellen in einem Punkt einig: Wenn Sie in einem GxP-Umfeld wie der Pharma- oder Medizinprodukteindustrie tätig sind, müssen Sie die Good Manufacturing Practice und die Good Distribution Practice einhalten. Sie müssen Ihre temperaturempfindlichen Produkte
herstellen, handhaben, lagern und transportieren.
Was bedeutet GxP-Validierung?
Gemäss GxP-Vorschriften wie GMP, GDP und GLP ist die GxP-Validierung ein strukturierter und dokumentierter Prozess, mit dem nachgewiesen wird, dass Systeme, Prozesse und Software zuverlässig funktionieren und dauerhaft regelkonforme Ergebnisse liefern. Die GxP-Validierung stellt sicher, dass Datenintegrität, Produktqualität und regulatorische Anforderungen jederzeit erfüllt werden. Dabei umfasst die Validierung viele Bereiche – von Geräten über IT-Systeme bis hin zu kompletten Arbeitsabläufen.
Alle Funktionen, die für die Produktqualität, Datenintegrität und Einhaltung gesetzlicher Vorschriften relevant sind, müssen validiert werden.
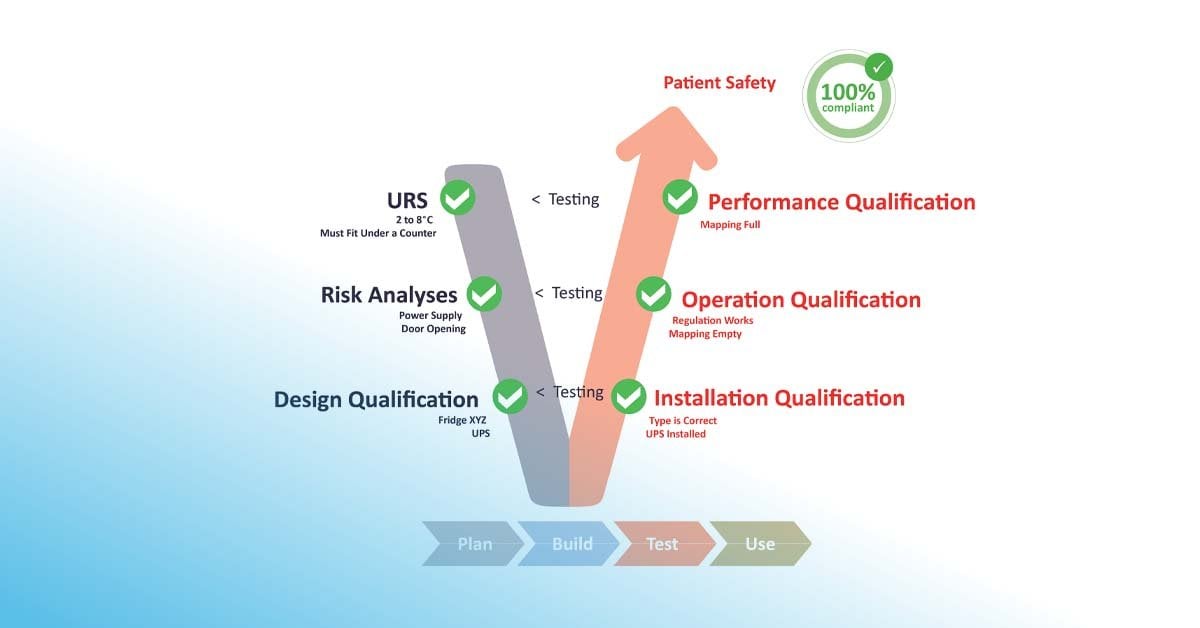
GxP-Qualifizierung konzentriert sich darauf, nachzuweisen, dass Anlagen, Geräte und Systeme gemäss vordefinierten Anforderungen installiert sind und korrekt funktionieren, sodass sie den beabsichtigten Zweck gemäss den Benutzeranforderungen (user requirement specification, URS) erfüllen. Sie folgt einem strukturierten Ablauf mit den Schritten Design Qualification (DQ), Installation Qualification (IQ), Operational Qualification (OQ) und Performance Qualification (PQ). Durch die Qualifizierung wird dokumentiert belegt, dass die Ausrüstung für den vorgesehenen Einsatz geeignet ist.
Neben der Einhaltung von Vorschriften und Bestimmungen ist die Qualifizierung von entscheidender Bedeutung für die Gewährleistung der Produktqualität, der Versorgungssicherheit und eines sicheren und wirksamen Ergebnisses für Verbraucher und Patienten. Über die GxP-Konformität hinaus gewährleistet die Qualifizierung die Kontinuität der Versorgung, die Datenintegrität und letztlich die Patientensicherheit.
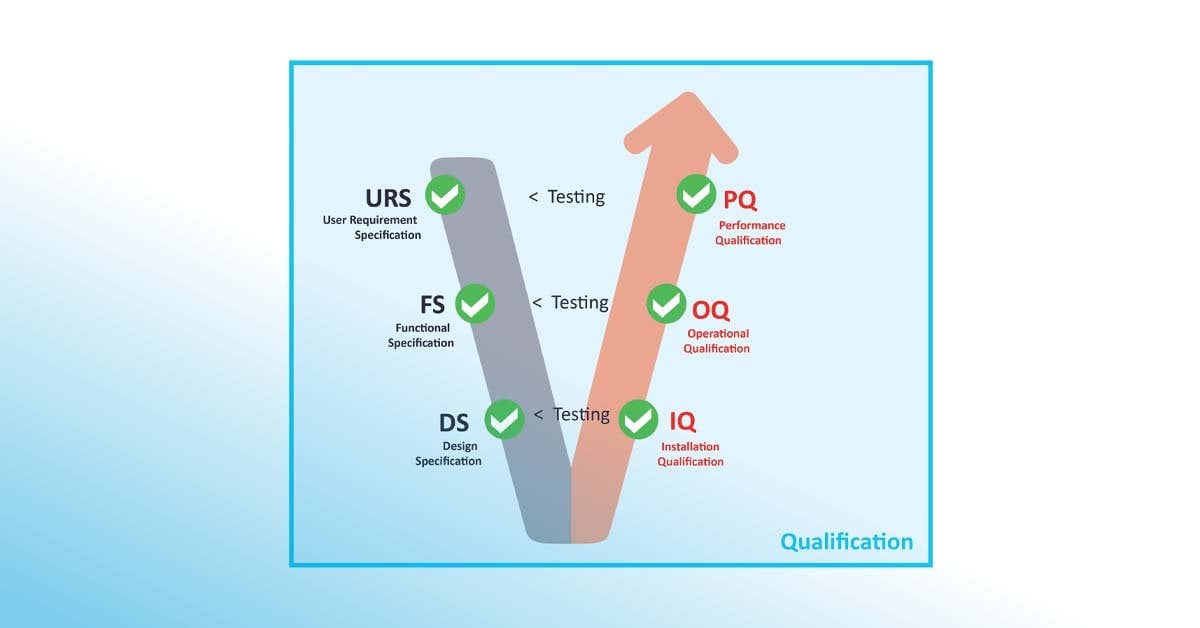
Dem GAMP® 5 V-Modell folgend wird der Qualifizierungsplan (QP) entwickelt, um eine Reihe von Massnahmen und Analysen zu definieren, einschliesslich Funktionsspezifikation (FS), Designspezifikation (DS), Risikobewertung, Implementierung, Installationsqualifizierung (IQ), Funktionsqualifizierung (OQ) und Leistungsqualifizierung (PQ). Das Ergebnis des Qualifizierungsprozesses wird in einem Qualifizierungsbericht (QR) festgehalten, aufgezeichnet und genehmigt. In jeder Phase sollte eine Reihe von Tests durchgeführt werden, um sicherzustellen, dass alle definierten Risiken vollständig behoben wurden.
Ein leicht zu befolgender, verständlicher Leitfaden, um den Begriff GMP näherzubringt.
Was ist GxP-Temperatur-Mapping?
Kalte Luft ist dichter und schwerer und drückt wärmere, leichtere Luft nach oben. Luftverdrängung und Luftunterschiede stellen ein Risiko für temperaturempfindliche Produkte dar, die in kontrollierten Umgebungen hergestellt, gelagert und transportiert werden, sei es in einem Lagerhaus, einem Behälter, einem Kühlschrank oder einem Gefrierschrank.
Ein GxP-Temperatur-Mapping stellt daher die systematische Messung der Temperaturverteilung in kontrollierten Bereichen wie Lagerräumen, Kühlräumen oder Transportbehältern dar. Ziel ist es, mögliche Hot- und Cold-Spots im System zu identifizieren, um die Produktsicherheit und Stabilität während Lagerung und Transport zuverlässig zu gewährleisten.
Der Prozess identifiziert Messunsicherheiten und Schwankungen im Vergleich zu einer bekannten Einheit, indem die Temperatur an mehreren Stellen innerhalb einer Umgebung gemessen und dokumentiert wird. Das Temperatur-Mapping identifiziert die Bereiche, die innerhalb der zulässigen Parameter für die Lagerung Ihres Produkts liegen.
Die Mapping-Vorbereitung und die Zusammenfassung der Analyse können ein komplizierter und zeitaufwändiger Prozess sein. Der Mapping-Plan und das Protokoll beinhalten die Risikobewertung, auf deren Basis die Platzierung von Temperaturdatenloggern definiert und begründet wird. Wichtig ist, dass die verwendeten Geräte in validierten Prozessen hergestellt werden. Sie sollten an mehreren Punkten kalibriert werden, um den vorgesehenen Umgebungsbereich abzudecken. Die Anzahl der erforderlichen Messpunkte wird anhand von Volumenberechnungen festgelegt. Eine Mapping-Studie wird übereinstimmend mit behördlichen Vorgaben und weltweit anerkannten Standards über einen vordefinierten Zeitraum durchgeführt.
Bei der Mapping-Studie wird die Temperatur an bestimmten Stellen im Raum gemessen, um so ein Mapping-Netzwerk zu erstellen. Dieses berücksichtigt zwei Prinzipien:
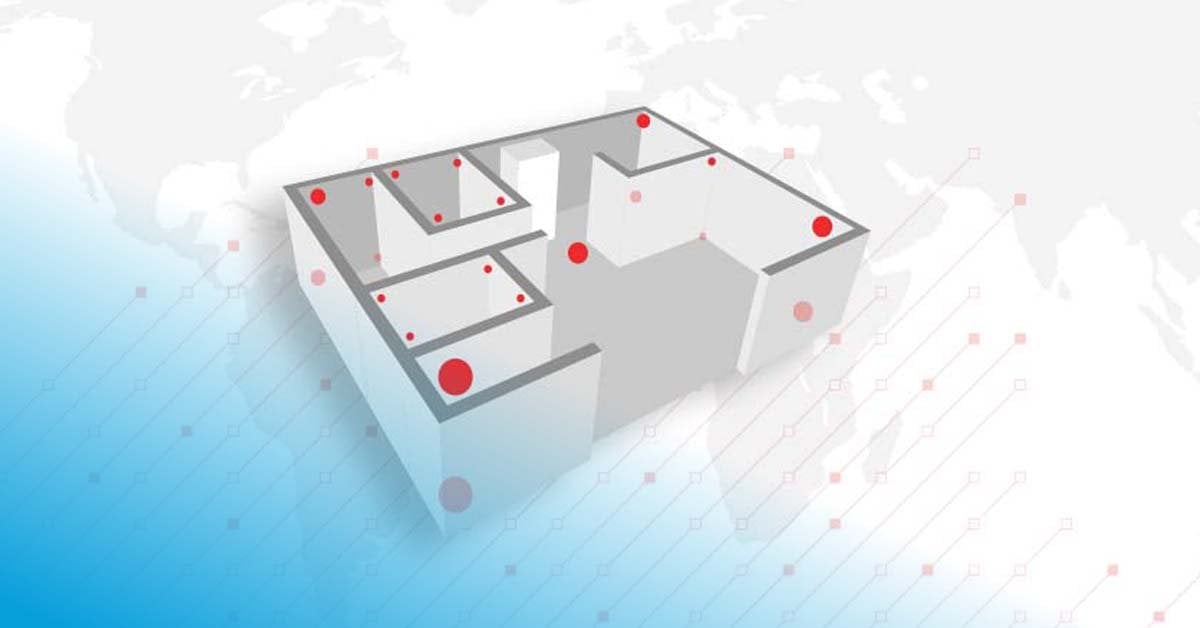
Einrichtung des Mappings: Die Sensoren werden installiert und konfiguriert, gut sichtbar markiert und an den jeweiligen Mapping-Punkten platziert.
Der Zweck der Mapping-Analyse und der Zusammenfassung besteht darin, Geräte oder Bereiche aufgrund der ermittelten Hot- und Cold-Spots und unter Berücksichtigung des vorgesehenen Bereichs und der Akzeptanzkriterien zuzulassen oder abzulehnen. Um weniger offensichtliche Risiken oder Trends zu erkennen, werden die durchschnittlichen Temperaturbedingungen und manchmal auch die mittleren kinetischen Temperaturen (MKT) analysiert. Diese Faktoren werden im zusammenfassenden Bericht festgehalten und sollten mit entsprechenden Empfehlungen und laufenden Aktionsplänen versehen werden. Beispielsweise: Wo in einem Raum sollen Datenlogger für ein kontinuierliches Monitoring platziert werden?
Gemäss dem V-Modell von GAMP® 5 definiert der Qualifizierungsplan (QP) eine Reihe von Massnahmen, darunter die Designqualifizierung (DQ), die Installationsqualifizierung (IQ), die Funktionsqualifizierung (OQ) und die Leistungsqualifizierung (PQ). Diese Schritte stehen im Einklang mit den Prinzipien der Computersystemvalidierung (CSV), die in GxP-Systemen angewendet werden, um sicherzustellen, dass die Softwareentwicklung und die Hardwareintegration den Qualitätsstandards entsprechen.
Alle Ergebnisse werden in einem Qualifizierungsbericht (QR) festgehalten, der Audit-Trails unterstützt und als dokumentierter Nachweis für die Einhaltung der CFR Part 11- und GxP-Richtlinien dient.
Lagerqualifizierung: Stellen Sie sicher, dass Ihre Lager- und Umschlagumgebungen konform sind und einem risikobasierten Ansatz folgen.
Gerätequalifizierung: Vergewissern Sie sich, dass alle Temperaturüberwachungsgeräte, Sensoren und Datenlogger GxP-konform sind, ordnungsgemäss kalibriert und gemäss der Guten Laborpraxis validiert wurden.
Bei temperaturkontrollierten Geräten und Bereichen ist die Mapping-Analyse Teil des Qualifizierungsplans. Häufig wird das Mapping während mehrerer Phasen des Qualifizierungsprozesses durchgeführt - typischerweise während der IQ-, OQ- und PQ-Phasen. Das Mapping ist der Prüf- und Bewertungsteil der Qualifizierung und liefert Ihnen Daten, um Trends zu erkennen, Ausfällen zu simulieren und die thermische Reaktionszeit zu bewerten. Das Mapping während der Qualifizierung umfasst häufig unterschiedliche Auslastungsgrade des zu untersuchenden Raums, beginnend mit einem leeren Raum bis hin zur typischen Betriebslast.
Eine Mapping-Studie definiert das Verhaltensmuster innerhalb des Raums, während die Qualifizierungsstudie eine detaillierte Analyse durchführt, um zu belegen, dass das Design und die Abläufe den erwarteten Ergebnissen entsprechen.
Gemäss den GxP-Richtlinien für die Validierung müssen Sie alle Geräte, die sich auf die Sicherheit von Patienten auswirken können, qualifizieren und deren Prozesse authentifizieren.
Zum relevanten Equipment gehören unter anderem:
Die Qualifizierung temperaturgeregelter Kühlgeräte umfasst risikobasierte Tests hinsichtlich Luftstrom, Beladung und Türöffnungen. Das Mapping gewährleistet die Einhaltung gesetzlicher Vorschriften und die fortlaufende Datenintegrität.
Grosse Lagerräume erfordern aufgrund von Umwelteinflüssen ein saisonales Temperatur-Mapping. Kühlräume müssen zwar weniger häufig gemappt werden, erfordern jedoch dennoch eine Validierung zur Einhaltung der GxP-Vorschriften.
Die Transportqualifizierung stellt sicher, dass temperaturempfindliche Güter während des Transports innerhalb des zulässigen Bereichs bleiben. Sowohl passiv isolierte Boxen als auch aktive Behälter müssen qualifiziert und gemappt werden, um die Anforderungen der Good Distribution Practice und CFR Part 11 zu erfüllen.
Im pharmazeutischen Sektor ist der Qualifizierungsprozess je nach Ausrüstung und Raum unterschiedlich. In einigen Fällen wird die Qualifizierung von spezialisierten technischen Betrieben durchgeführt. ELPRO orientiert sich am GAMP® 5 V-Modell, bei dem die Schritte 3, 4, 5 und 6 den Teil der Qualifizierung umfassen.
Im Folgenden finden Sie einige nützliche Beispiele für die Durchführung einer Qualifizierung und von Temperatur-Mappings unter verschiedenen Umständen:
Die Qualifizierung eines Kühlschranks ist einfach, da es sich um ein freistehendes Gerät handelt. Da diese Geräte in einem Raum oder einer Umgebung mit kontrollierter Temperatur arbeiten, beschränken sich die Risiken auf die Verstopfung des Luftauslasses, einen Stromausfall, unsachgemässe Befüllung und das Öffnen der Tür. Im Vergleich zu komplizierteren Geräten und personalisierten Anlagen sind die Risiken minimal.
Unternehmen betreiben in der Regel zahlreiche Kühl- oder Gefrierschränke, so dass Qualifizierungsprozesse oft in folgenden Schritten ablaufen:
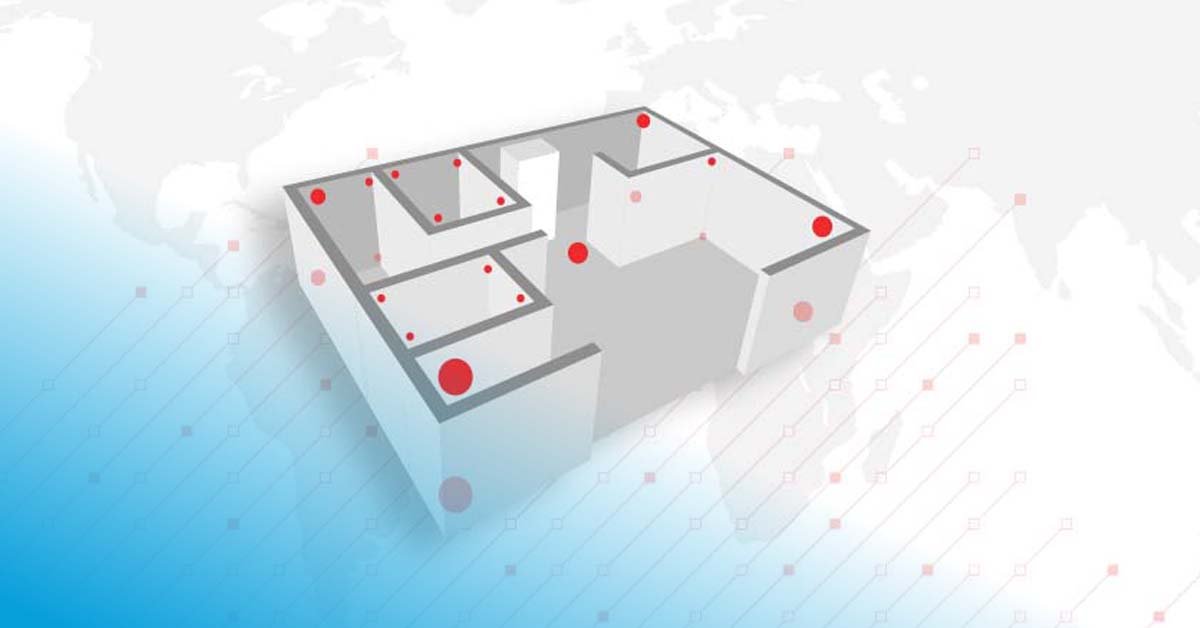
Lagerstättem, Kühlräume und Lagerhäuser sind keine Kühlschränke von der Stange. Jedes Produkt eignet sich für seine Branche durch massgeschneiderte Kontrollsysteme, Design und Luftströme. Es gibt viele unterschiedliche Einrichtungen mit verschiedenen Merkmalen und Anwendungen, die sich direkt auf die Wahl der Strategie auswirken.
Lager
Auswirkungen auf Qualifizierung und Mapping: Lager haben in der Regel Aussenwände, die den Umgebungsbedingungen und jahreszeitlichen Einflüssen direkt ausgesetzt sind. Die Isolierung des Gebäudes und das Fehlen von Fenstern und anderen Öffnungen sind entscheidend. Da die Umgebungsbedingungen einen Einfluss haben, sind Winter- und Sommer-Mappings erforderlich. Das Gleiche gilt für die Laderampe.
Kühlräume
Auswirkungen auf Qualifizierung und Mapping: Kühlräume sind in der Regel Räume innerhalb eines Gebäudes, deren Wände nicht direkt den Umgebungsbedingungen und jahreszeitlichen Einflüssen ausgesetzt sind. Oft ist es nicht notwendig, ein separates Winter- und Sommer-Mapping durchzuführen.
Laderampen und andere Einrichtungen
Auswirkungen auf Qualifizierung und Mapping: Ansatz und Komplexität der Qualifizierung und des Mappings anderer Einrichtungen werden bestimmt durch die Produkte, die dort gelagert oder abgefertigt werden, deren gesetzliche Auflagen für die Kennzeichnung und die Dauer des Aufenthalts in diesem Bereich.
Da Unternehmen in der Regel viele Lastwagen und Lieferwagen in ihrem Fuhrpark betreiben, werden die Qualifizierungsprozesse in Flotten durchgeführt:

Die Qualifizierung einer Transportbox oder eines Behälters ist nicht ganz so einfach, da sich der zu qualifizierende Gegenstand in einer unkontrollierten Umgebung bewegt. Klären Sie zunächst den Verwendungszweck und die Versandart – auf der Strasse, in der Luft oder auf dem Wasser. Berücksichtigen Sie die Transportzeit sowie den Temperaturbereich zu Beginn des Transports, während des Transports und am Zielort.
Es gibt zwei Möglichkeiten, die Einhaltung der geeigneten Umgebungstemperaturen während der GxP-Validierung zu bestätigen:
Es gibt Unterschiede zwischen passiven Kühlboxen und aktiven Heiz-/Kühlbehältern. Das sollten Sie über die beiden Arten wissen:
Passive Kühlboxen
High-Level-Risikobewertung: Das grösste Risiko stellen Verpackungsfehler dar, beispielsweise eine fehlerhafte Aufbereitung des PCM. Sobald eine Sendung auf dem Weg ist, ist die Lösung äusserst stabil und es bestehen nur noch minimale Risiken.
Aktive Behälter
High-Level-Risikobewertung: Aktive Container sind zwar leicht zu beladen, aber während des Transports bestehen signifikante Risiken durch menschliches Versagen (z. B. kein Wiederaufladen) und mechanisches Versagen. Heiz- und Kühlbehälter bestehen aus Hunderten von mechanischen und elektronischen Komponenten, die ausfallen können.
Sobald Sie den Behälter ausgewählt und seinen Zweck definiert haben, können Sie mit dem Qualifizierungsprozess beginnen, indem Sie die Schritte des V-Modells wie bereits erläutert anwenden.
Die GxP-konforme Validierung einer Transportstrecke oder eines Netzwerks beginnt mit der Qualifizierung der Ausrüstung; Sie ermitteln die richtigen Gegenstände innerhalb eines Netzwerks. Um die richtigen Gegenstände zu finden, müssen Sie die Ausrüstung, wie z. B. Boxen, Fahrzeugflotten und Behälter, gruppieren.
Kriterien für die Gruppierung der Transportelemente sind unter anderem:
Nachdem Sie das Netzwerk in ähnliche Kategorien eingeteilt haben, können Sie eine High-Level-Risikoanalyse durchführen. Die clusterspezifischen Risiken sollten beschrieben und bewertet werden. Je höher das Risiko eingestuft wird, desto grösser muss der Fokus auf der Definition von Massnahmen zur Risikominderung liegen. Nach der Bildung von Clustern und der Durchführung der Risikoanalyse muss nun jedes "Clusterelement" qualifiziert werden. Die folgende Tabelle gibt einen Überblick über mögliche Cluster, Risiken und Massnahmen zur Risikominimierung:
/Qualification%20and%20Mapping/Risk%20Strategy.png?width=855&name=Risk%20Strategy.png)
Sie wissen nun, wie Sie verschiedene Arten von Geräten und Räumen qualifizieren und validieren sowie Mappings durchführen können, um die Vorschriften der Pharmaindustrie einzuhalten. Mit hervorragenden Geschäftspraktiken können Sie die Rechte Ihrer Kunden schützen und die Rentabilität steigern. Gerne unterstützt ELPRO Sie bei der Bewältigung der komplexen Prozesse mit unseren GxP-Validierungsservices und weiteren Monitoringlösungen für Ihre Daten. In welchem speziellen Markt Sie auch unterwegs sind: unsere Experten stellen sicher, dass Sie stets regelkonform arbeiten. Kontaktieren Sie uns noch heute!
Die Validierung spielt eine zentrale Rolle in der GxP-Compliance, da sie sicherstellt, dass Systeme, Prozesse und Geräte wie vorgesehen funktionieren. Sie legt besonderen Fokus auf Datenintegrität und die Minimierung von Risiken für Produktqualität und Patientensicherheit. Typische Validierungsaktivitäten finden sich in der Pharma-, Biotech- und Medizinprodukteindustrie, beispielsweise die Qualifizierung von Produktionsanlagen, Softwarevalidierung oder Temperaturmapping in Lagerräumen und Transportbehältern.
GxP steht für „Good x Practice“, wobei x für verschiedene Bereiche wie Herstellung (GMP), Labor (GLP) und Vertrieb (GDP) steht. Es handelt sich um einen Oberbegriff für Vorschriften und Richtlinien, die Qualität, Sicherheit und Compliance in Branchen wie der Pharmaindustrie, der Biotechnologie und dem Gesundheitswesen gewährleisten.
Einige gängige GxP-Standards sind:
Diese Richtlinien tragen dazu bei, die Produktqualität, die Einhaltung gesetzlicher Vorschriften und die Patientensicherheit zu gewährleisten.
Der wesentliche Unterschied zwischen GxP- und Non-GxP-Projekten liegt in den für sie geltenden regulatorischen Standards und Compliance-Anforderungen. Diese Unterschiede sind besonders relevant in Branchen wie der Pharmaindustrie, der Biotechnologie und dem Gesundheitswesen, in denen Produktqualität, Patientensicherheit und die Einhaltung gesetzlicher Vorschriften von grösster Bedeutung sind.
GxP-Prokte
GxP bezieht sich auf eine Reihe von regulatorischen Richtlinien, die sicherstellen sollen, dass Produkte konsistent nach Qualitätsstandards hergestellt und kontrolliert werden. Diese Richtlinien sind in Branchen wie der Pharmaindustrie, Life Sciences und dem Gesundheitswesen von entscheidender Bedeutung.
Non-GxP-Projekte
Non-GxP-Projekte sind Projekte, die keine Einhaltung der GxP-Vorschriften erfordern und möglicherweise nicht derselben strengen Aufsicht unterliegen. Diese Projekte konzentrieren sich in der Regel eher auf allgemeine betriebliche Verbesserungen als auf die Einhaltung branchenspezifischer Standards.
Wchtige Unterschiede
Zusammenfassend lässt sich sagen, dass GxP-Projekte stark reguliert sind und strenge Dokumentations- und Compliance-Massnahmen erfordern, während Non-GxP-Projekte in der Regel flexibler sind und nicht dem gleichen Mass an behördlicher Kontrolle unterliegen.
GxP steht für „Good [X] Practice”, wobei „X” für verschiedene Bereiche wie Herstellung (GMP), Labor (GLP) oder Klinik (GCP) stehen kann. Es handelt sich um eine Reihe von Richtlinien und Qualitätsstandards, die in der Pharma-, Biotech- und Life-Science-Branche verwendet werden, um sicherzustellen, dass Produkte sicher, wirksam und konsistent hergestellt werden. Die Einhaltung von GxP hilft Unternehmen, Vorschriften einzuhalten, die Produktqualität aufrechtzuerhalten und die Patientensicherheit zu gewährleisten.
GxP-Grundsätze werden in mehreren regulierten Branchen außerhalb der Pharmabranche angewendet, wobei sich der Schwerpunkt und die Anforderungen jedoch unterscheiden können:
Biotechnologie:
Medizinprodukte:
Lebensmittel & Getränke:
Kosmetika:
Fazit:
Während GxP-Grundsätze wie Dokumentation, Rückverfolgbarkeit und Qualitätskontrolle in allen Branchen üblich sind, sind die GxP-Vorschriften in der Pharmabranche in der Regel am strengsten, da sie sich direkt auf die Patientensicherheit und die Wirksamkeit der Produkte auswirken. Andere Branchen können GxP-Verfahren zum Schutz der Verbraucher anwenden, aber die behördliche Aufsicht und die Risiken unterscheiden sich.
Benutzeranforderungen (User Requirements Specification, Abkürzung URS) für Reinräume – Erstellen Sie das passende Lastenheft. Hier finden Sie...
Der Einstieg in die Pharma-GxP kann unübersichtlich sein. Verschaffen Sie sich mit diesem Artikel einen umfassenden Gesamtüberblick und erhalten Sie...
Sie sind sich unsicher, welche GxP-Vorschriften in Deutschland und der Schweiz für die Pharmaindustrie gelten? Hier erfahren Sie alles, was Sie...