Produktion & Reinraum
Überwachungs-Lösungen für Temperaturdaten und mehr in Produktion und Reinraum
Reinräume und Produktionsbereiche in der Pharmaindustrie sind sensible Zonen – selbst geringfügige Abweichungen bei Temperatur, Feuchte oder Druck können die Produktqualität und Patientensicherheit beeinträchtigen. Bei unverpackten Produkten ist das Risiko einer Kontamination besonders hoch. Der Schutz der Produktintegrität und des Personals erfordert Überwachungslösungen, die Folgendes sicherstellen:
- Lückenlose Überwachung und Aufzeichnung aller relevanten Umgebungsparameter
- Sofortige Alarmierung über klar definierte Eskalationswege
- Regelkonforme Systemqualifizierung und vollständige Dokumentation
- Übersichtliche Datenvisualisierung, integrierte Analysetools und automatisierte Berichtserstellung
- Skalierbares Systemdesign für künftige Erweiterungen in der Produktion
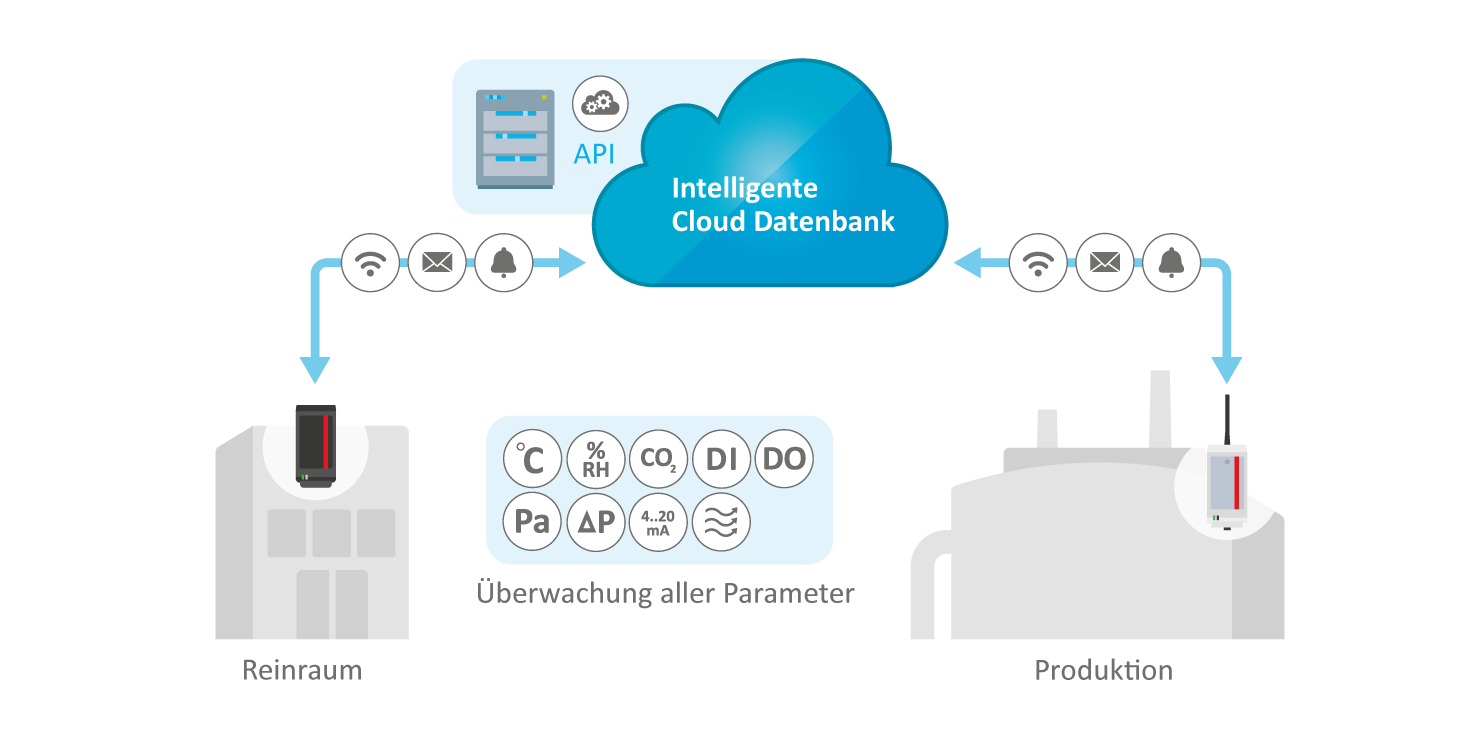
Relevante Parameter nahtlos überwacht und dokumentiert
-
Alle Parameter
-
Systemintegration
-
Globale Compliance

Erweiterte Lösungen für Überwachung und Kontrolle
- Umfassende Überwachung aller kritischen Parameter wie Temperatur, relative Luftfeuchtigkeit, Partikelanzahl, Differenzdruck, Luftstrom, CO₂-Gehalt und Türöffnungen
- Integration zusätzlicher Sensorsignale oder externer Geräte möglich
- Akustische und visuelle Alarme – direkt im Raum, auf dem Flur oder über flexible Anzeigesysteme
- Sensoren kalibriert gemäss ISO 17025-Norm

Von der Einstiegslösung bis zur komplexen Multi-Site-Installation
- Kabelgebundene und drahtlose Optionen – ideal für modulare Produktionsumgebungen
- Vernetzte Systeme, die sich nahtlos in bestehende Infrastrukturen integrieren lassen – geeignet für kleine Standorte ebenso wie für grosse Anlagen
- Anbindung einer unbegrenzten Anzahl Sensoren

Gute vorbereitet für Audits von Anfang an
ELPRO-Lösungen erfüllen höchste GMP-Anforderungen und gewährleisten eine durchgängig belastbare Datenintegrität in allen regulierten, kritischen Bereichen.
- GAMP® 5-validiert
- Konform mit FDA 21 CFR Part 210/211 (USA)
- Entspricht EU-GMP Annex 1 (Europa)
- Erfüllt den PIC/S GMP-Leitfaden (international)
- Kalibriert gemäss ISO 17025
- Konform mit ISO 14644 (Reinraumklassifizierung, international)
- Unterstützt ICH Q7 (internationale Leitlinie für GMP bei Wirkstoffen)
Skalierbare, integrierte Lösung für verschiedenste Parameter
Die Hard- und Softwarelösungen von ELPRO ermöglichen eine zuverlässige Überwachung von Reinräumen und Produktionsbereichen in der Pharma- und Life-Sciences-Branche. Sie sind auf höchste regulatorische Anforderungen ausgelegt, sichern eine konstante Umgebungskontrolle und unterstützen fundierte, schnelle Entscheidungen.
- Modulare, anpassbare Systeme mit kabelgebundenen und drahtlosen Sensoren für alle kritischen Parameter
- Verfügbar als On-Premise- und als Software-as-a-Service-Lösung
- Intuitive Software mit 24/7-Zugriff und klarer Datenvisualisierung
- Integration in bestehende Benutzerverwaltung
(Active Directory oder Single Sign-On) - Zentrale Verwaltung mehrerer Standorte über eine Lösung
- Sofortige Alarmierung und Benachrichtigungen bei Abweichungen
- Automatisierte Berichte und Auswertungen
- API-Schnittstelle für nahtlose Datenübertragung in andere Systeme

Kabelgebundene Module
- °C, % rF, 4 bis 20 mA, DI, DO
- Stabile Durchdringung in abgeschirmten Räume
- Unbegrenzte Anzahl von Sensoren

Funkmodule
- °C, % rF, 4 bis 20 mA
- Funkfrequenz: 868 / 915 MHz
- Flexible Positionierung der Sensoren
- Bis zu 50 Sensoren pro lokaler Funkbrücke
Von GxP-Services bis zum Reinraum-Überwachung
Erfahren Sie, wie ein US-amerikanisches Biotech-Startup auf GxP-konforme Beratung und Services von ELPRO setzt, um ein benutzerfreundliches Umgebungsüberwachungssystem erfolgreich zu implementieren – für fünf Reinräume, -80 °C-Tiefkühlschränke, Kühlschränke, Inkubatoren und ein Lager.
Unser Biotech-Kunde schätzte und würdigte das Projektmanagement von ELPRO, unseren GxP-Service vor Ort und unsere Beratung. Die einfache Bedienbarkeit unserer Software überzeugte ihn sofort.
Compliance leicht gemacht
Globale Vorschriften und Standards sind komplex – aber mit der notwendigen Expertise sind sie zu meistern. Mit umfassenden Lösungen sorgen wir dafür, dass Unternehmen die Compliance-Anforderungen erfüllen und für anstehende Audits gerüstet sind und weltweit jederzeit ein reibungsloser Betrieb gewährleistet ist. Wir kümmern uns um die Komplexität, damit Sie sich auf das Wesentliche konzentrieren können: Ihren Erfolg.

Kontaktieren Sie noch heute unsere Spezialisten für Reinräume und Produktions-Umgebungen

Häufige Fragen zur Überwachung von Reinräumen und Produktionsbereichen
Streng regulierte Umgebungen wie Reinräume und Produktionsstätten in der Biotech-, Life-Sciences- und Pharmaindustrie erfordern eine präzise Kontrolle zahlreicher Umgebungsparameter. Die folgenden Fragen helfen bei der Bewertung geeigneter Lösungen für eine regelkonforme Umweltüberwachung:Was sind die Gesamtbetriebskosten (TCO)?
Erstellen Sie eine detaillierte Aufschlüsselung aller Kosten, einschliesslich:
- Anschaffungskosten für Hardware
(Sensoren, Datenlogger, Gateways, Displays etc.) - Server- und Softwarelizenzierung
(Unbefristete Lizenzen vs. Abonnement-Modelle) - Kosten für Installation und Erstvalidierung
(z. B. IQ/OQ-Dokumentation, Inbetriebnahme vor Ort) - Jährliche Wartungs- und Supportgebühren
(Software-Updates, technischer Support, Serviceverträge) - Sensorersatz und Kalibrierung
(inkl. Rückführung auf ISO 17025, ggf. Vor-Ort- oder Laborkalibrierung) - Schulung und Wissenstransfer
(Einweisung, Trainingsdokumentation, Schulung neuer Mitarbeiter) - Zukünftige Upgrade-Möglichkeiten und Kompatibilität
(Skalierbarkeit des Systems, neue Technologien, Schnittstellen) - Versteckte Kosten
(z. B. Anpassungen an der IT-Infrastruktur, zusätzliche Software-Integrationen, Netzwerk- oder Stromversorgungserweiterungen)
Fragen zu Datenintegrität und zur Compliance?
- Wie stellt Ihre Lösung die Konformität mit 21 CFR Part 11 in Bezug auf elektronische Aufzeichnungen und Signaturen sicher?
- Bitte stellen Sie eine ausführliche Dokumentation zu den Audit-Trail-Funktionen Ihres Systems bereit, einschliesslich Zeitstempel, Benutzerauthentifizierung und Änderungsverfolgung.
- Welche integrierten Funktionen verhindern Datenmanipulationen und gewährleisten eine vollständige Rückverfolgbarkeit bei behördlichen Inspektionen?
Sind Validierungsunterlagen und Audit Trails enthalten?
Die vollständige Validierungsdokumentation sollte Folgendes enthalten:
- Dokumentation zur Installationsqualifizierung (IQ)
- Protokolle zur Funktionsqualifizierung (OQ)
- Vorlagen zur Leistungsqualifizierung (PQ)
- Dokumentation zur Risikobewertung
- Detaillierte Testskripte und Akzeptanzkriterien
- Standardarbeitsanweisungen (SOPs) für die Validierung
- Traceability-Matrix, die Systemanforderungen mit Validierungsnachweisen verknüpft
Welche Real-Time-Überwachungs- und Alarmierungsfunktionen sind enthalten?
Stellen Sie gezielte Fragen wie:
- Beschreiben Sie die Real-Time-Überwachungsfunktionen Ihres Systems über mehrere Parameter hinweg (CO₂, O₂, Temperatur, Partikelanzahl, Differenzdruck, relative Luftfeuchtigkeit).
- Welche Alarmierungsmechanismen sind vorhanden? Kann das System Folgendes bereitstellen:
- Sofortige Benachrichtigungen über mehrere Kanäle (E-Mail, SMS, Mobile App)
- Eskalationsprotokolle bei Überschreiten kritischer Grenzwerte
- Individuell anpassbare Alarmschwellen für unterschiedliche Bereiche der Anlage
- Wie schnell reagiert das System – von der Erkennung einer Abweichung bis zur Generierung eines Alarms?
Wie sieht mit Datenintegration und Systeminteroperabilität aus?
- Wie lässt sich die Lösung in bestehende Facility-Management-Systeme, LIMS und andere Unternehmenssoftware integrieren?
- Welche Datenübertragungsprotokolle werden unterstützt (z. B. HL7, REST API)?
- Kann das System verschlüsselte Daten in behördlich geforderten Formaten (PDF, CSV, XML) exportieren?
- Beschreiben Sie das Softwarevalidierungspaket zur Sicherstellung von Systemkompatibilität und Compliance während der Implementierung.
Wie zuverlässig sind Sensor- und Hardwarelösungen?
- Besorgen Sie sich detaillierte Spezifikationen zur Sensorgenauigkeit, zu Kalibrieranforderungen und zur Langzeitstabilität
- Wie hoch ist die mittlere Betriebsdauer zwischen Ausfällen (MTBF) Ihrer Sensoren und Überwachungsgeräte?
- Was sind Redundanzkonzepte und Failsafe-Mechanismen der Sensoren?
- Welche Kalibrier- und Wartungsintervalle werden empfohlen?
- Wie geht das System mit Sensorfehlern oder Unterbrechungen der Datenerfassung um?
Ist eine Cloud- und Cybersicherheitsinfrastruktur erforderlich?
- Wenn Sie eine cloudbasierte Lösung in Betracht ziehen, lassen Sie sich die Sicherheitszertifizierungen der Cloud-Infrastruktur vorlegen (z. B. ISO 27001, SOC 2).
- Klären Sie, welche Verschlüsselungsprotokolle für ruhende Daten und Datenübertragungen verwendet werden.
- Wie erfolgt die Zugriffskontrolle – einschliesslich Multi-Faktor-Authentifizierung und rollenbasierten Berechtigungen.
- Lassen Sie sich die Konzepte zur Notfallwiederherstellung und zur Aufrechterhaltung des Geschäftsbetriebs erläutern.
- Erkundigen Sie sich nach Ihrem Prozess für Batch-Management und Schwachstellenüberwachung.
Sind Referenzen zu Implementierungen in ähnlichen Einrichtungen verfügbar?
Bitten Sie um Referenzen, die Folgendes belegen:
- Erfolgreiche Implementierungen in FDA-regulierten Umgebungen
- Erfahrung in spezifischen Teilbereichen (z. B. Biologika, Herstellung kleiner Moleküle, Zelltherapie); nachgewiesene Leistungen in folgenden Bereichen:
- Aufrechterhaltung der Datenintegrität
- Erfolgreiche behördliche Audits
- Minimale Systemausfallzeiten
- Effektiver Support bei kritischen Vorfällen
Fragen Sie nach:
- Referenzkunden
- Case Studies oder Berichte zu erfolgreichen Implementierungen
- Bereitschaft zur Organisation von Referenzbesuchen oder vertieften Gesprächen
Newsletter-Anmeldung ELPRO News
ELPRO wird die in diesem Formular angegebenen Informationen dazu verwenden, mit Ihnen in Kontakt zu bleiben und Ihnen Updates sowie Marketing-Informationen per E-Mail zu übermitteln.


