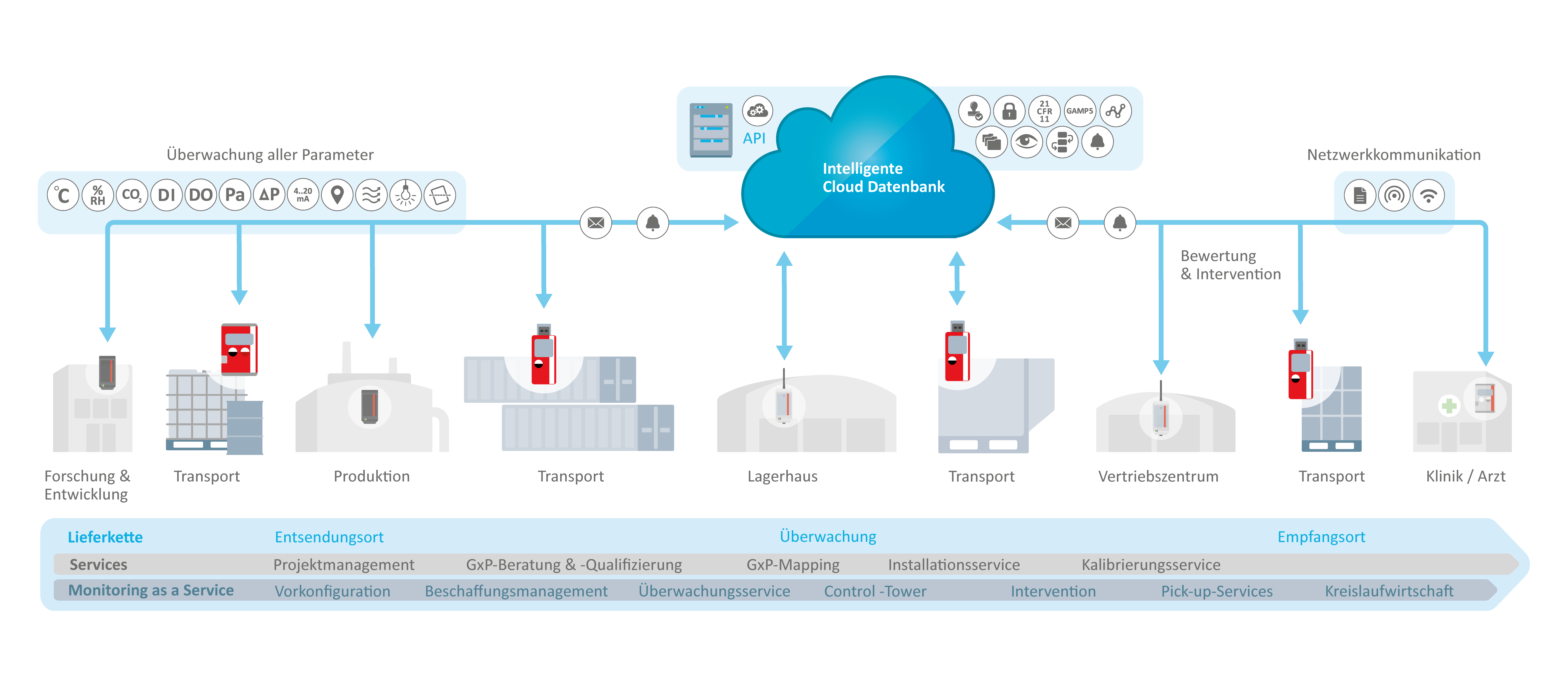
Die Überwachung der Pharma- und Biotech-Kühlkette unterliegt strengen regulatorischen Vorgaben, die von internationalen und nationalen Behörden festgelegt werden. So schreibt die FDA in 21 CFR Part 211 umfassende Validierungs- und Überwachungsmassnahmen für die Lagerung biologischer Produkte vor. Die GDP-Richtlinien (Good Distribution Practice) verlangen eine lückenlose Dokumentation der Temperaturkontrolle entlang der gesamten Vertriebskette.
Anhang 15 der EU-GMP-Richtlinien legt Qualifizierungsanforderungen für Kühllagersysteme fest, die für den Erhalt der therapeutischen Wirksamkeit entscheidend sind. Die WHO gibt in ihrer Technical Report Series 961 konkrete Vorgaben für temperaturempfindliche Arzneimittel – insbesondere für Impfstoffe und monoklonale Antikörper. Die EMA betont in ihren GDP-Leitlinien die Notwendigkeit einer kontinuierlichen Temperaturüberwachung mit validierter Ausrüstung, insbesondere bei neuartigen Therapien.
Für Gentherapien und zellbasierte Produkte gelten die Prinzipien des ICH Q9 zur risikobasierten Qualitätssicherung auch bei der Validierung der Kühlkette. Die PIC/S GDP-Anforderungen fordern ein präzises Temperatur-Mapping und ein systematisches Abweichungsmanagement. In Ländern wie China verlangt das überarbeitete Arzneimittelgesetz zudem eine unterbrechungsfreie Dokumentation der Temperatur. Diese teils überlappenden Regelwerke sichern weltweit die Integrität temperaturempfindlicher Produkte – und damit die Gesundheit der Patientinnen und Patienten.