GxP-Beratung & Qualifizierung
Mit ELPROs GxP-Services auf der sicheren Seite
Die Komplexität regulatorischer Anforderungen macht Compliance mühsam und zeitaufwändig. GxP-Beratungs- und Qualifizierungsservices nehmen Ihnen diese Last ab und sorgen dafür, dass Sie gut auf anstehende Audits vorbereitet sind.
Die Services umfassen Räume und Lager, Geräte, Systeme und Flotten und beinhalten:
- Gerätequalifizierung
- Transportvalidierung und -verifizierung
- Lager- und Raumqualifizierung
- Systemvalidierung
-
GxP-Beratung
-
GxP-Qualifizierung & Validierung
-
GxP-Mappings

GxP-Beratung
Kunden profitieren von vier Jahrzehnten Erfahrung bei der Überwachung von Umgebungsbedingungen in der Pharmaindustrie und bei der GxP-Compliance-Beratung. Die Berater von ELPRO bieten Schritt-für-Schritt-Unterstützung bei:
- Navigation durch komplexe Vorschriften
- Verbesserung von Prozessen
- Vorbereitung auf zukünftiges Wachstum
- Entwicklung von Strategien zur Sicherstellung der Compliance, unabhängig von der aktuellen Betriebsgrösse

GxP-Qualifizierung und Validierung
Sorgfältige Qualifizierungsservices stellen sicher, dass Geräte und Umgebungsüberwachungssysteme den strengen GxP-Standards entsprechen. Es werden Risikobewertungen sowie DQ-, IQ-, OQ- und PQ-Dokumentationen bereitgestellt, die die Integrität der Betriebsabläufe gewährleisten und wertvolle Produkte schützen.
Das Angebot umfasst:
- Qualifizierung von Lager- und Transporteinheiten
- Validierung/Verifizierung von Transportprozessen
- Temperatur- und Feuchtigkeits-Mappings, einschliesslich Stresstests
- Erstellung individueller Qualifizierungs-/Validierungsdokumentationen

GxP-Temperatur- und Feuchtigkeits-Mappings
Genau Mappings der Umgebungsbedingungen sind entscheidend für die Einhaltung von GxP-Compliance. Die Services von ELPRO umfassen detaillierte Mappings der Umgebungsparameter, insbesondere der Temperatur und der relativen Luftfeuchtigkeit, und gewährleisten so die Produktqualität und die Einhaltung gesetzlicher Vorschriften. Dazu gehören:
- Lager- oder Reinräume
- Container
- Thermische Verpackungen oder Boxen
- Kühl-, Tiefkühlschränke oder ULT
- LKW, Vans oder gesamte Fuhrpark
- Lane Studies
Sie haben die Wahl zwischen Vor-Ort- oder Remote-Mappings sowie Self-Service-Mappingkits.
Vom Temperatur-Mapping zur Behördenfreigabe in 2 Monaten
Lesen Sie mehr über die erfolgreiche Durchführung eines GMP-konformen Temperatur-Mappings im hochautomatisierten AutoStore-Lager einer der führenden Online-Apotheken Deutschlands. Erhalten Sie Einblicke in die Herausforderungen, den Prozess und die Ergebnisse.
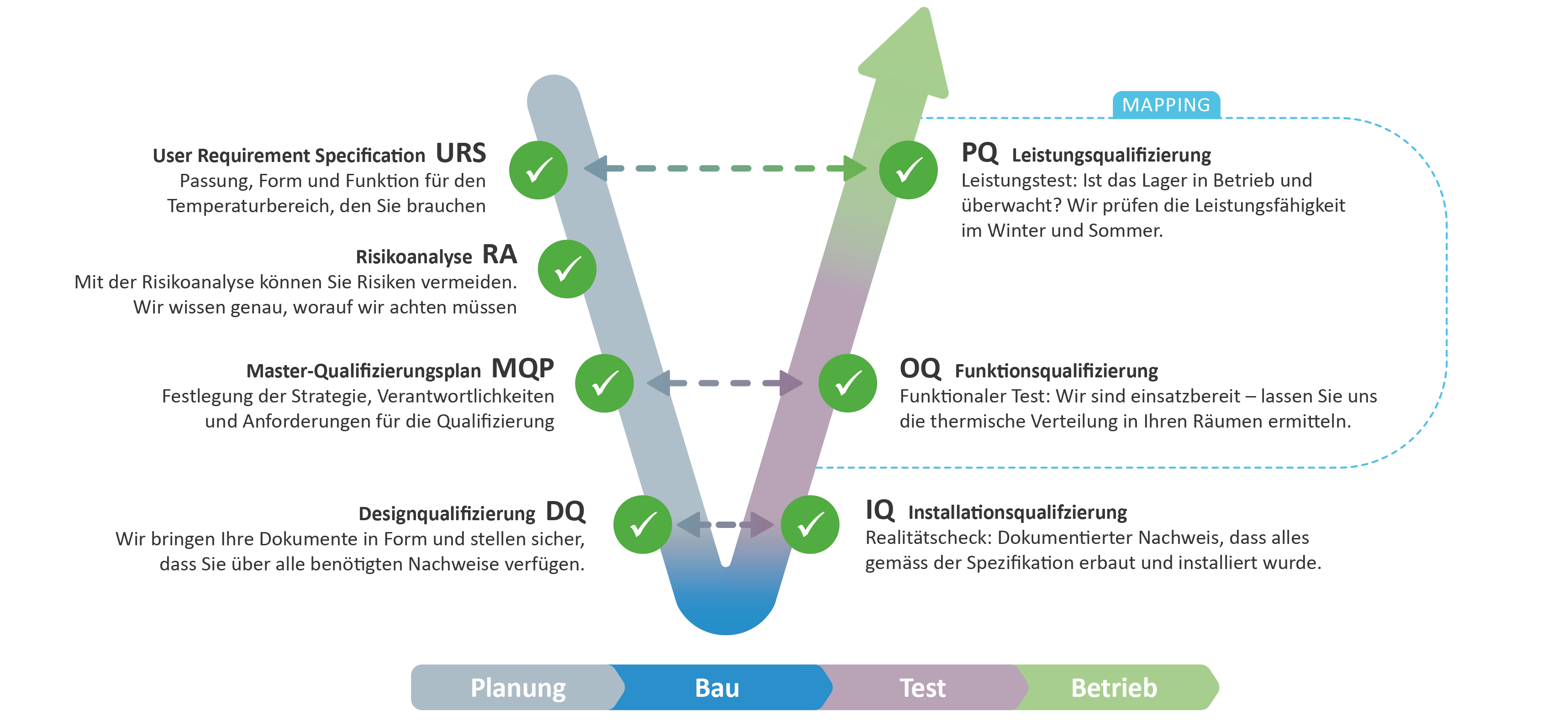
Das V-Modell immer im Blick
Das V-Modell ebnet Ihnen den Weg zu lückenloser Compliance. Sie entscheiden, in welcher Phase Sie unser Expertenwissen für Ihre GxP-Compliance nutzen möchten.
Halten Sie Ihr Umgebungsüberwachungssystem konform
Weltweit vertrauen Logistik- und Biopharmaunternehmen sowie solche, die klinische Studien durchführen, auf GxP-Service-Experten von ELPRO.
500+
Lagerhäuser qualifiziert
10,000+
Temperatur-Mappings in Einrichtungen
20,000+
Kalibrierungen jährlich
ELPRO erleichterte die Qualifizierung der Temperatur-Monitoringgeräte und unserer Kühlhäuserdurch exzellentes Fachwissen und bedarfsorientierte technische Unterstützung
Unsere Zusammenarbeit mit ELPRO bei der Qualifizierung und beim Mapping unseres neuen GMP/GDP-konformen Lagers war sehr erfolgreich. Alle Schritte bis zur behördlichen Inspektion wurden professionell begleitet. Letztendlich hatten wir keinerlei Mängel.
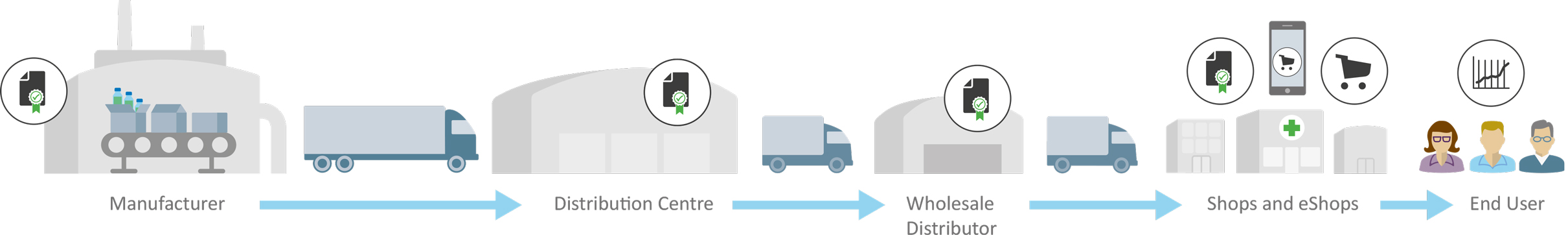
Unübertroffener GxP-Support für Ihre gesamte Lieferkette
GxP-Services müssen die gesamte Lieferkette unterstützen, um eine kontinuierliche Temperaturkontrolle und Compliance zu gewährleisten:
- Massgeschneiderte Lösungen überwachen den kritischen Temperaturbereich für lebensrettende, temperaturempfindliche Produkte aufrecht.
- Cloud-basierte Lösungen bieten Echtzeitüberwachung und Dateneinblicke für eine nahtlose Nachverfolgung.
- Experten minimieren Compliance-Risiken und gewährleisten Produktsicherheit und Compliance von der Lagerung bis zum Vertrieb.
Compliance leicht gemacht
Globale Vorschriften und Standards sind komplex – aber mit der notwendigen Expertise sind sie zu meistern. Mit umfassenden Lösungen sorgen wir dafür, dass Unternehmen die Compliance-Anforderungen erfüllen und für anstehende Audits gerüstet sind und weltweit jederzeit ein reibungsloser Betrieb gewährleistet ist. Wir kümmern uns um die Komplexität, damit Sie sich auf das Wesentliche konzentrieren können: Ihren Erfolg.

Sprechen wir über GxP. Nehmen Sie Kontakt mit uns auf.

Häufige Fragen zu GxP-Services, GxP-Beratung und Qualifizierung
Wofür steht GxP?
GxP steht für „Good x Practice“, wobei das „x“ für verschiedene Bereiche wie Herstellung (GMP), Labor (GLP) und Vertrieb (GDP) steht. Es handelt sich um einen Oberbegriff für Vorschriften und Richtlinien, die Qualität, Sicherheit und Compliance in Branchen wie Pharmazie, Biotechnologie und Healthcare gewährleisten..
Einige gängige GxP-Standards sind:
- GMP (Good Manufacturing Practice) – Gewährleistet, dass Produkte durchgängig nach Qualitätsstandards hergestellt und kontrolliert werden.
- GLP (Good Laboratory Practice) – Gewährleistet die Zuverlässigkeit und Integrität von Laborstudien.
- GDP (Good Distribution Practice) – Gewährleistet die ordnungsgemässe Handhabung, Lagerung und den Transport von pharmazeutischen Produkten.
- GCP (Good Clinical Practice) – Gewährleistet die ethische Durchführung, Sicherheit und Zuverlässigkeit klinischer Studien und schützt gleichzeitig die Rechte und das Wohlergehen der Teilnehmer.
Diese Richtlinien tragen dazu bei, die Produktqualität, die Einhaltung gesetzlicher Vorschriften und die Patientensicherheit zu gewährleisten.
Was ist ein GxP-validiertes System?
Ein GxP-validiertes System ist ein computergestütztes System, das getestet und dokumentiert wurde, um sicherzustellen, dass es die regulatorischen Anforderungen an Datenintegrität, Genauigkeit, Zuverlässigkeit und Sicherheit in GxP-Umgebungen (wie GMP, GLP oder GDP) erfüllt. Die wichtigsten Aspekte eines GxP-validierten Systems sind:
- Einhaltung von Vorschriften – Das System muss gesetzliche Anforderungen wie FDA 21 CFR Part 11, EU Annex 11 und andere branchenspezifische Richtlinien erfüllen.
- Validierungsprozess (CSV – Computerized System Validation) – Das System durchläuft eine Installationsqualifizierung (IQ), eine Funktionsqualifizierung (OQ) und eine Leistungsqualifizierung (PQ), um sicherzustellen, dass es wie vorgesehen funktioniert.
- Datenintegrität (ALCOA+-Prinzipien) – Stellt sicher, dass Daten zuordenbar, lesbar, zeitnah, original, genau und vollständig, konsistent, dauerhaft und verfügbar sind.
- Audit-Trail und Sicherheit – Das System muss alle Änderungen verfolgen, die Benutzerzugriffskontrolle sicherstellen und unbefugte Änderungen verhindern.
- Dokumentierte Nachweise – Die Validierung muss vollständig dokumentiert werden, um die Konformität bei Audits und Inspektionen nachweisen zu können.
Was sind die regulatorischen Anforderungen von GxP?
GxP-Vorschriften sind Richtlinien und Standards, die die Produktqualität, Sicherheit und Datenintegrität in Branchen wie der Pharma, Biotechnologie und Healthcare währleisten. Diese Vorschriften variieren je nach Region und Anwendung, basieren jedoch auf gemeinsamen Grundsätzen. Die wichtigsten GxP-Vorschriften sind:
1. Vorschriften für Herstellung und Laboratorien
- EU-GMP-Leitlinien (EudraLex Band 4)
- US-FDA 21 CFR Part 210 und 211
- WHO-Leitlinien
- OECD-Grundsätze der GLP
- US-FDA 21 CFR Part 58
2. Vorschriften für Vertrieb und Lieferkette
- EU-GDP-Leitlinien (2013/C 343/01)
- US-FDA-GDP-Leitlinien für die Industrie
- WHO-Leitlinien
-
ISPE Good Practice Guide
3. Vorschriften zur Datenintegrität und elektronischen Aufzeichnungen
- FDA 21 CFR Part 11 – Legt Anforderungen für elektronische Aufzeichnungen und Signaturen fest, um die Datenintegrität sicherzustellen.
- EU Annex 11 – Bezieht sich auf computergestützte Systeme in GxP-Umgebungen.
- MHRA- und WHO-Richtlinien zur Datenintegrität – Betonen die Einhaltung der ALCOA+-Prinzipien (Attributable, Legible, Contemporaneous, Original, Accurate, plus Complete, Consistent, Enduring, Available).
4. Vorschriften für Medizinprodukte und klinische Studien
- ISO 13485 – Qualitätsmanagementsystem für Medizinprodukte.
- ICH GCP (Good Clinical Practice) Leitlinien – Gewährleistet ethische und wissenschaftliche Standards in klinischen Studien.
Was sind typische GxP-Services?
Typische GxP-Services gewährleisten die Einhaltung gesetzlicher Standards in Branchen wie Pharmazie, Biotechnologie und Healthcare. Diese Services umfassen:
1. Qualifizierungs- und Validierungsservices
- Spezifikation der Benutzeranforderungen (URS)
- Risikobewertung
- Temperatur-Mappings – Sicherstellung, dass kontrollierte Umgebungen (z. B. Lagerhäuser, Kühlschränke, Gefrierschränke) die GxP-Anforderungen erfüllen.
- Gerätequalifizierung (IQ/OQ/PQ) – Installations-, Funktions- und Leistungsqualifizierung von Überwachungs- und Speichersystemen.
2. Überwachungs- und Compliance-Lösungen
- Umgebungsüberwachung (Temperatur, Luftfeuchtigkeit, CO₂ usw.) – Kontinuierliche Überwachung der Lager- und Transportbedingungen.
- Abweichungsmanagement und Umgang mit Alarmen – Sicherstellung einer zeitnahen Reaktion auf Bedingungen, die ausserhalb der Spezifikationen liegen.
- Audit Trail und Datenintegritätssicherung – Sichere Datenprotokollierung und Dokumentation zur Einhaltung der Vorschriften.
3. GxP-Beratung und Audits
- Unterstützung bei der Einhaltung gesetzlicher Vorschriften – Beratung zu GMP, GDP und anderen GxP-Anforderungen.
- Risikobewertungen und Schwachstellenanalysen – Identifizierung potenzieller Compliance-Risiken und Verbesserungsmöglichkeiten.
- Vorbereitung auf Audits und Inspektionen – Vorbereitung auf behördliche Inspektionen (z. B. FDA, EMA).
4. Schulungen und Dokumentation
- GxP-Schulungen für Mitarbeiter – Schulung der Mitarbeiter zu regulatorischen Anforderungen und Best Practices.
- Entwicklung von Standardarbeitsanweisungen (SOPs) – Erstellung dokumentierter Richtlinien zur Einhaltung der Vorschriften.
Diese Services helfen Unternehmen dabei, Compliance zu gewährleisten, Produktqualität sicherzustellen und Patientensicherheit zu gewährleisten.
Welche drei Elemente sind für GxP relevant?
Die drei Grundsätze von GxP sind:
- Rückverfolgbarkeit – Die Möglichkeit, die Entwicklung, Herstellung, Prüfung und den Vertrieb eines Produkts zu verfolgen, um Transparenz und Nachvollziehbarkeit zu gewährleisten.
- Verantwortlichkeit – Klare Definition von Verantwortlichkeiten und Dokumentation von Massnahmen, um die Einhaltung von Vorschriften und Standards sicherzustellen.
- Datenintegrität – Sicherstellung, dass Daten während ihres gesamten Lebenszyklus korrekt, vollständig, konsistent und sicher sind, um die Einhaltung gesetzlicher Vorschriften und die Entscheidungsfindung zu unterstützen.
Diese Grundsätze tragen dazu bei, Produktqualität, Compliance und Patientensicherheit in Branchen wie der Pharmaindustrie und dem Gesundheitswesen aufrechtzuerhalten.
Welche Rolle spielt das V-Modell bei der Qualifizierung?
Das V-Modell ist ein strukturierter Ansatz, der bei der GxP-Qualifizierung und -Validierung verwendet wird, um sicherzustellen, dass Geräte, Einrichtungen und computergestützte Systeme den gesetzlichen Anforderungen entsprechen. Es wird häufig in den Bereichen Good Manufacturing Practice (GMP), Good Laboratory Practice (GLP) und Good Distribution Practice (GDP) angewendet.
Das V-Modell folgt einer „V“-Form, wobei:
- die linke Seite die Anforderungen und das Design definiert,
- die rechte Seite das System anhand dieser Anforderungen überprüft und validiert und
- die Mitte (Implementierungsphase) die Installation und Konfiguration des Systems darstellt.
Jeder Schritt auf der linken Seite hat eine entsprechende Testphase auf der rechten Seite, wodurch vollständige Rückverfolgbarkeit und Konformität gewährleistet sind.
Was sind die 5 R's der Risikobewertung?
Die 5 R's der Risikobewertung bieten einen strukturierten Ansatz zur effektiven Identifizierung und zum Management von Risiken. Sie helfen Unternehmen, insbesondere in regulierten Branchen wie der Pharmaindustrie, die Compliance aufrechtzuerhalten und potenzielle Ausfälle zu minimieren. Die Anwendung der 5 R's gewährleistet einen proaktiven und systematischen Ansatz für das Risikomanagement in stark regulierten Umgebungen.
- Recognize (Erkennen) – Identifizieren Sie potenzielle Risiken, die sich auf die Produktqualität, die Patientensicherheit oder die Compliance auswirken könnten. Dazu gehört die Analyse von Prozessen, Anlagen und Schwachstellen in der Datenintegrität.
- Rank (Einstufen) – Bewerten und priorisieren Sie Risiken anhand ihrer Wahrscheinlichkeit, Schwere und Erkennbarkeit. Methoden wie FMEA (Failure Modes and Effects Analysis) helfen dabei, zu bestimmen, welche Risiken sofortige Massnahmen erfordern.
- Respond (Reagieren) – Entwickeln und implementieren Sie Massnahmen zur Risikokontrolle, wie z. B. Prozessverbesserungen, Schulungen, Systemvalidierungen oder zusätzliche Überwachungsmassnahmen, um Risiken zu beseitigen oder zu mindern.
- Record (Aufzeichnen) – Dokumentieren Sie Risikobewertungen, Strategien zur Risikominderung und Korrekturmassnahmen, um die Einhaltung von GxP-Vorschriften wie CFR 21 Part 11, ICH Q9 und ISO 14971 sicherzustellen.
- Review (Überwachen) – Überwachen Sie Risiken kontinuierlich und aktualisieren Sie Bewertungen, um Änderungen in Prozessen, Vorschriften oder neuen Gefahren Rechnung zu tragen. Regelmässige Überprüfungen gewährleisten langfristige Compliance und Betriebssicherheit.
Newsletter-Anmeldung ELPRO News
ELPRO wird die in diesem Formular angegebenen Informationen dazu verwenden, mit Ihnen in Kontakt zu bleiben und Ihnen Updates sowie Marketing-Informationen per E-Mail zu übermitteln.


